自32年前全球首个艾滋病毒感染案例出现以来,人类对艾滋病的研究就未曾止步。日前,来自中国科学院上海药物研究所和美国Scripps研究所的科学家取得突破性成果,成功揭示了抗HIV感染药物马拉韦罗(Maraviroc)的作用机制。该成果发表在最新一期的《科学》上。
这项研究由中科院上海药物研究所的研究员吴蓓丽负责。她和同事利用蛋白质结晶等技术获得了人体细胞表面受体蛋白CCR5的高分辨率分子三维结构,这对理解艾滋病毒感染细胞的机制很有帮助。上海药物研究所已经开始根据研究结果进行药物设计,目前进展良好。
在HIV侵染宿主细胞的早期过程中,CCR5是一种关键的受体蛋白。此前的研究发现,具有突变CCR5蛋白的人群对HIV的侵染免疫,CCR5蛋白的作用因此备受关注。研究人员希望研发能抑制CCR5蛋白生物活性的药物,以阻断HIV病毒对细胞的侵染。然而,尽管目前已有少量能抑制CCR5活性的药物投入使用,其具体的作用机制在此前却并未得以阐明。
研究人员曾通过对CCR5受体蛋白的关键位点进行突变,得到这一蛋白的功能区域。而在这项研究中,研究人员则利用分子成像技术找到了马拉韦罗与CCR5受体的结合位点。结果显示,马拉韦罗与CCR5的结合位点与HIV已知的结合位点及其天然配体的结合位点都不相同,这表明马拉韦罗并非通过竞争性抑制影响HIV病毒入侵进程。进一步的研究表明,马拉韦罗可以改变CCR5蛋白的分子构象,使其处于未激活状态,从而阻断HIV病毒对其的识别和结合,进而阻止HIV病毒侵入细胞。
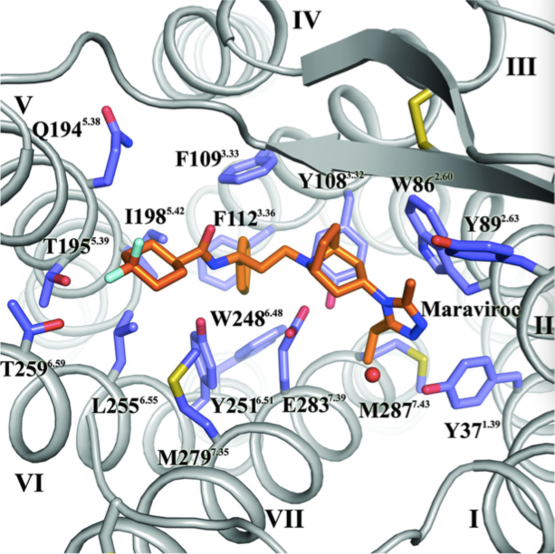 CCR5蛋白(蓝色碳链所示)与马拉韦罗(橙色碳链所示)的结合位点。图片来源:Qiuxiang Tan,et al. (2013)Science.
CCR5蛋白(蓝色碳链所示)与马拉韦罗(橙色碳链所示)的结合位点。图片来源:Qiuxiang Tan,et al. (2013)Science.
此外,研究人员还对人体细胞表面另一蛋白CXCR4的结构进行了解析。CXCR4是与CCR5类似的HIV受体,通常被认为是HIV病毒晚期感染中所需的蛋白。研究人员通过成像结晶和比对发现,HIV病毒对受体的选择性可能是由这两种蛋白表面电荷的分布、形状等细微差异造成的。这一结果有助于进一步解释HIV病毒侵染的细节,进而推动抗HIV感染新药的研发。
吴蓓丽表示,研究团队将进一步分析CCR5和CXCR4蛋白与HIV病毒表面蛋白gp120和CD4所形成的复合物,深入探索病毒感染机制。
参考文献:Tan Q., et al. (2013) Structure of the CCR5 Chemokine Receptor–HIV Entry Inhibitor Maraviroc Complex. Science.
