春种一粒粟,秋收万颗子。能不能收得更多?在美国冷泉港实验室,一批植物学家致力于通过改变作物自身的基因来增产。我和扎克里·利普曼(Zach Lippman)小组里的“番茄编辑”们试图通过摸索控制番茄花期的关键基因来调整番茄产量,取得了突破性进展,并将论文发表在了《自然》子刊《自然-遗传学》(Nature Genetics)上。
人类的农业史是无数动植物的驯化史。通过将大自然原有的动植物人工驯养为牲畜或栽培为作物,我们开始定居生活,建立农业社会,最终发展出灿烂的文明。每一种作物都具有的独特驯化和育种历史,仔细考察这些悠远而曲折的历史点滴,我们会发现作物背后的精彩故事,并可能探索出更令人称奇的结果。我们研究的番茄就是其中一个例子。
三片叶子一组花
野生番茄(Solanum lycopersicum)原产于南美的秘鲁地区,最早由南美原住民驯化种植。由于野生番茄的果实体型很小,只有小葡萄那么大,驯化的目标一直以来都是使果实更大,果肉更多。经过长期坚持不懈的人工选择,我们最终获得了果实巨大,果肉多汁的番茄,并由此衍生出无数番茄作为原料的美味佳肴。
如果你仔细观察番茄的枝桠结构,会发现它是一种十分有规律的组合,就好像番茄能自己计算和数数。在最常见的菜园番茄植株上,一般来说枝桠结构是这样的:从幼苗开始,主枝产生7-9片叶子,然后开出一组花。此后,便不断从旁边伸出一条侧枝,生长出3片叶子,再开出一组花。循环往复,向上生长。一般情况下,每条侧枝都会取代主枝位置,使植株看起来就像是一条主枝在一直向上生长,而一组又一组的花开在侧面。
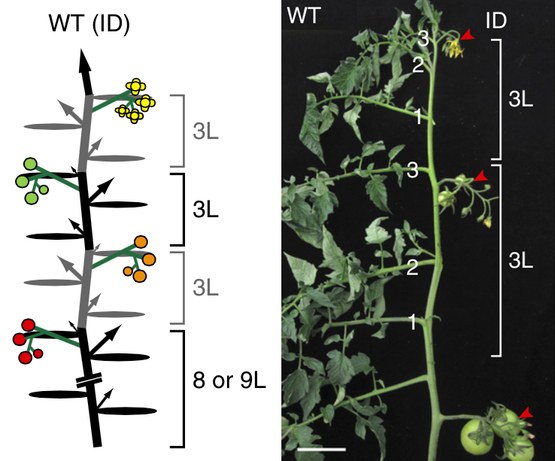 野生型番茄植株的枝桠结构和开花事件示意图(左)和代表性照片(右)。图片来源:Nature Genetics
野生型番茄植株的枝桠结构和开花事件示意图(左)和代表性照片(右)。图片来源:Nature Genetics
目前在温室中进行的番茄种植正是依赖于这种枝桠生长方式:捆绑在柱子或者网上的植株全年可一直生长,直至从下到上从左到右绕整个温室一圈。我们可以全年不断获得渐进成熟的果实。在这种番茄植株上,每组果实(开花事件)之间必定间隔3片叶子。
短小精悍的sp番茄
20世纪初,美国佛罗里达的农民发现了一个奇特的番茄品种。这个品种的番茄并不产生间隔3片叶子的花序。在第一朵花开放后,这种番茄迅速产生2片和1片叶子的侧枝并开3组花,然后主枝就停止生长。在种满番茄的菜地里,这个品种的番茄显得特别矮,枝桠总量也少,就像被修剪过一样,所以人们给它起了个名字,称作sp(self pruning,自修剪)。
sp番茄虽然看起来又小又矮,却有着巨大的优点:它迅速生长开花,然后停止生长,所以几乎所有果实可以同时成熟。此外,由于这个品种体型低矮,使机械化种植和收获番茄第一次成为了可能。顺理成章地,sp品种开启了番茄的大规模工业化生产,也使大量应用番茄的各种食品工业迅猛发展。当你在麦当劳把薯条伸到番茄酱中时,你所品尝到的几乎一定是sp番茄。
可是sp番茄究竟是怎么来的呢?这个谜底直到1998年才被揭开。以色列耶路撒冷大学的丹尼·扎米尔(Dani Zamir)研究组最终用现代分子生物学技术成功分离克隆了SP基因[1]。sp番茄所有的性状都来源于SP基因上一个小小的突变。而SP基因所编码的,正是开花植物生长过程中非常重要的一种植物激素——反开花素。就像漫画和电影中的“X战警”一样,具有这种SP基因突变的番茄不但没有成为“恶魔”,反而成为了立下奇功的“超级”番茄。
而这,只是神奇变种番茄的一个开端。
开花素与反开花素的对峙
我们已经提到,SP基因编码的是番茄的“反开花素”,顾名思义,那是一种与“开花素”对应的物质。开花素(florigen)在植物下部的叶中产生,并通过某种方式运输到顶端分生组织,促使顶端分生组织停止更多叶的分化,而转为制造开花组织。它就像一个信号的集成者,收集所有促进植物开花的信号,然后自己充当信使,从叶中跑到顶端分生组织中,启动植物的开花过程。
而反开花素,正是在顶端分生组织表达,阻止开花过程发生的激素。在开花植物中,开花素和反开花素的作用像一对在门两边同时推门的人,一个想要开门,一个想要关门,达成微妙的平衡——正是这种平衡使番茄在每2个开花事件之间的叶子维持在3片,不多也不少。
在sp番茄中,基因突变使反开花素失去了作用,相当于使在门背后挡着不让开门的力量消失了。这样,当开花素从植物下面冲上来的时候,一下子就能把门撞开,番茄迅速开花。这就是为什么在sp番茄中开花事件之间的叶子越来越少,最后索性开完花后停止生长。
如果我们把这推门的力量——开花素——也撤走,这“门”会怎样呢?2008年,扎米尔研究组发现了开花素和反开花素基因都突变了的番茄植株sft:sp,这种番茄很难开花,整棵植株一般只开寥寥几朵花。“sft”(Single Flower Truss,单独花)的名字便由此而来。
然而,这看似先天不足的突变株居然也可以书写神奇:当研究者把sft:sp番茄和sp番茄杂交后,子一代(F1)的番茄产量比它的亲本sp还增加了40%!子一代从sp亲本继承了一个健康的开花素基因,同时也从sft:sp亲本继承了一个突变的开花素基因,却能比拥有2个健康开花素基因的sp产生更多果实。这是一种罕见的单基因杂种优势案例[2]。
尽管乍看之下,这“以一胜二”看似不符合直觉,但只要回到开花素与反开花素的平衡模型,我们会发现问题其实非常简单。
失去反开花素(sp番茄),开花加快;再失去开花素(sft:sp番茄),开花停止;加回一个开花素基因(F1),开花恢复,但因为开花素还少一份,所以开花速率较sp番茄降低。而开花速率降低,便意味着增加了开花事件之间间隔的叶子数量,最后增加了总开花数量,形成更多的果实。
花是一扇门,增产靠平衡
在仔细研究番茄枝桠结构随开花素和反开花素增减而发生的变化后,美国冷泉港扎克里·利普曼(Zach Lippman)研究组发现取消反开花素后,番茄枝桠结构会对开花素的数量非常敏感,开花素数量的微妙变化往往能引起整个植株枝桠结构的连锁变化,最终影响果实产量[3]。
搞清楚了这个模型后,我们得到非常自然但又非常激动人心的推论:在缺乏反开花素的番茄中,任何控制开花素数量的因素都可以改变开花素和反开花素的平衡,进而改变枝桠结构。摸索到那扇“门”的最佳位置,我们便能够实现果实增产。
怎样才能找到这些影响因素呢?开花事件之间的叶子数量便是最有力的武器:如果开花事件之间叶子变少了(少于3片),说明开花速率太快,开花素太多了;而如果开花事件之间叶子变多了(等于或多于3片),说明开花速率变慢了,开花素又太少了。
如此这般,开花素的多少就成为了我们调节番茄果实产量的一个“秘密”开关。在这种思想的指导下,利普曼的研究小组筛选了大量突变体,最终发现了一系列开花素数量被改变的突变体[4]。通过互相杂交把这些不同的突变重新排列组合,研究者得以探索产量最高的组合方式。
 不同番茄突变株的产量示意图。图片来源:Nature Genetics
不同番茄突变株的产量示意图。图片来源:Nature Genetics
这种自由的随机组合不仅能帮助我们找到开花素调节开关的每一个档位,还有助于发现所能调节的最高和最低值。最终,利用番茄中这许许多多的“X战茄”——突变株们,我们进一步理解了开花素和反开花素在番茄发育中的作用,把番茄的驯化向前推进了一大步:以前,驯化的目标侧重于果实大小和质量;现在,有赖这些突变体,我们又有了足够的育种工具来优化枝桠结构,以最大化果实数量。
现在,研究者正试图把这一思想应用到其他作物上,因为开花素和反开花素的微妙平衡存在于一切开花植物中。当前正是利用突变体进行类似育种试验的黄金时代,在生物学的最前沿,一种能方便快捷的精确改造物种基因组,产生人工突变体的新技术CRISPR,正蒸蒸日上地发展着[5]。在这些利好条件下,相信很快,我们就能够在任何作物的任何基因上制造任何我们想要的突变,使我们拥有近乎无限的突变体材料来进行排列组合,制造产量更高,质量更好的作物。(编辑:Calo)
参考文献:
- Pnueli L, Carmel-Goren L, Hareven D, Gutfinger T, Alvarez J, Ganal M, Zamir D, Lifschitz E. The SELF-PRUNING gene of tomato regulates vegetative to reproductive switching of sympodial meristems and is the ortholog of CEN and TFL1. Development. 1998 Jun;125(11):1979-89.
- Krieger U, Lippman ZB, Zamir D. The flowering gene SINGLE FLOWER TRUSS drives heterosis for yield in tomato. Nat Genet. 2010 May;42(5):459-63.
- Jiang K, Liberatore KL, Park SJ, Alvarez JP, Lippman ZB. Tomato yield heterosis is triggered by a dosage sensitivity of the florigen pathway that fine-tunes shoot architecture. PLoS Genet. 2013;9(12):e1004043.
- Park SJ, Jiang K, Tal L, Yichie Y, Gar O, Zamir D, Eshed Y, Lippman ZB. Optimization of crop productivity in tomato using induced mutations in the florigen pathway. Nat Genet. 2014 Dec;46(12):1337-42.
- Doudna JA, Charpentier E. Genome editing. The new frontier of genome engineering with CRISPR-Cas9. Science. 2014 Nov 28;346(6213):1258096.
