从一个细胞到另一个细胞,从一代生命到下一代生命,控制人类形态的遗传信息在我们身体内已经流淌了几十万年。
DNA持续受到来自环境的攻击,但它们的结构完整程度却出人意料。托马斯·林达尔(Tomas Lindahl)、保罗·莫德里奇(Paul Modrich)以及阿齐兹·桑贾尔(Aziz Sancar)因为描述并解释了细胞修复DNA的机制以及对遗传信息的保护措施,而被授予了2015年的诺贝尔化学奖。

来自精子的23条染色体和来自卵子的23条染色体结合,决定了你的基础。它们一同构成了你的基因组的最初版本。在精子卵子相遇时,构成你所需的遗传物质就已经齐备了。如果从这最初的细胞中取出DNA分子,并把它们排成一线,那大概会有2米长。
当受精卵继续分裂时,DNA分子会进行复制,子细胞也会得到一整套完整的染色体。之后,细胞会再次分裂:两个变成四个,四个变成八个。一周后,受精卵就分裂成了128个细胞,每一个细胞都有自己的一套遗传物质。
你的DNA的总长度此时已接近300米。现在——在细胞进行了数十万亿次分裂后——你的DNA的长度已经可以在地球和太阳之间往返250次了。尽管你的遗传物质进行了很多次复制,但最新一次复制的产物仍几乎和最初受精卵中的版本一模一样。
这就是生物分子的伟大之处,因为从化学的角度来说,这本应该是不可能的。任何化学过程都很容易出现随机错误。另外,你的DNA每天还要受到有害辐射和活性分子的攻击。实际上,从化学角度来说,早在你发育成胎儿之前,你就应该变成乱成一锅粥了。
DNA被一大群蛋白质监视着
我们的DNA之所以能年复一年地保持完整,归功于一系列分子修复机制的存在:众多蛋白质监控着基因们。它们持续地校对着基因组,并对任何已发生的损伤进行修复。
2015年诺贝尔化学奖被授予托马斯·林达尔、保罗·莫德里奇和阿齐兹·桑贾尔,以表彰他们从分子层面阐明了这些至关重要的过程。他们系统性的工作对理解细胞运作做出了卓越的贡献,并为了解一系列遗传病的分子成因、癌症和衰老的发生机制提供了知识。
托马斯·林达尔、保罗·莫德里奇和阿齐兹·桑贾尔各自独立地阐明了与人类相关的若干DNA修复过程。而故事始于托马斯·林达尔。他生于瑞典——那正是阿尔弗雷德·诺贝尔的故乡。
生命在延续,所以DNA必须可修复
“DNA到底有多稳定?”托马斯·林达尔早在20世纪60年代末就对这个问题深感好奇。那时,科学界相信作为生命基础的DNA分子必须极度坚实,没有别的可能。演化确实需要突变的存在,但每一代的突变都是有限的。如果遗传信息太过不稳定,多细胞生物就无法存在了。在美国普林斯顿大学当博士后的时候,林达尔研究RNA——一种与DNA相近的分子。研究很不顺利。在实验中,他必须加热RNA,但这个过程不可避免地会导致RNA快速降解。那时人们都知道RNA比DNA要更敏感,但如果RNA在受热时都被毁灭得如此迅速,DNA真的能一辈子保持稳定吗?这个问题占据了林达尔的脑海。
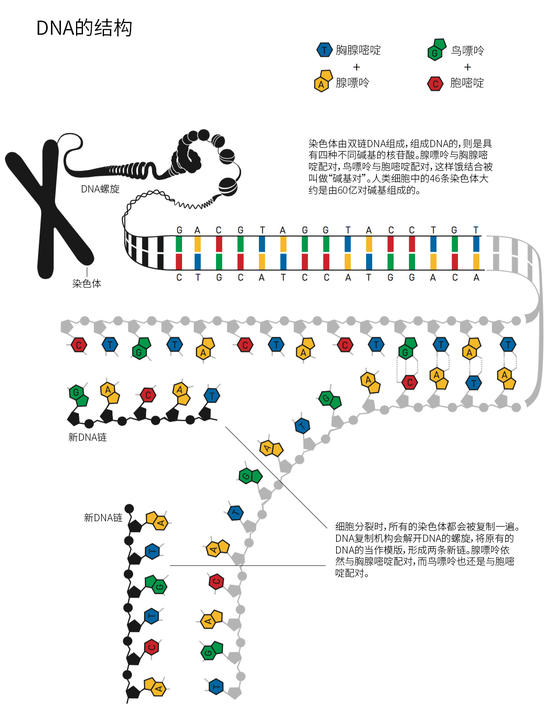
那时离他开始寻找这个问题的答案还有几年光景。几年后,林达尔搬回到瑞典,进入斯德哥尔摩的卡罗林斯卡学院。一些直截了当的实验验证了他的怀疑:DNA其实会发生缓慢但可观测的降解。据林达尔估计,基因组每天会发生数千起灾难性的潜在损伤,人类要在地球上延续,这些损伤显然不可能真的发生。他的结论是,肯定有分子机制负责对这些DNA缺陷进行修复。本着这个思路,托马斯·林达尔打开了通向崭新研究领域的大门。
特殊的酶来去除DNA损伤
和人的DNA一样,细菌DNA同样由核苷酸的四种碱基腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)和胸腺嘧啶(T)组成。托马斯·林达尔开始利用细菌DNA来寻找修复酶。DNA的化学弱点之一,它的胞嘧啶(C)很容易丢失一个氨基,这可能导致遗传信息改变。在DNA的双螺旋中,C总是与G配对,但当氨基丢失后,受损的碱基往往与A配对。因此,如果允许这个缺陷继续存在,下一次DNA复制时就会发生一次突变。林达尔意识到,细胞对此必有某种防范机制。他成功发现,有一种细菌酶能去除DNA里受损的胞嘧啶。1974年,他发表了他的发现。
托马斯·林达尔完成了“碱基切除修复”的拼图
35年的成功工作就此展开,在此期间,托马斯·林达尔发现并研究了许多细胞用来修复DNA所用的工具蛋白。在20世纪80年代初,他因缘际会来到英国,在伦敦,他接受了帝国癌症研究基金会(Imperial Cancer Research Fund)的一个职位。1986年,他成为了新成立的剑桥大学克莱尔学堂实验室(Clare Hall Laboratory)主任,这个实验室随后以其科学创造力而闻名遐迩。
一点一滴,林达尔拼起了“碱基切除修复(base excision repair)”是如何作用的分子图景,糖基化酶(glycosylases)正是DNA修复过程中的第一步,这种酶很类似他1974年发现的那个细菌的酶。碱基切除修复也发生在人类身上,在1996年,托马斯·林达尔还在体外设法重建了人类的修复过程。
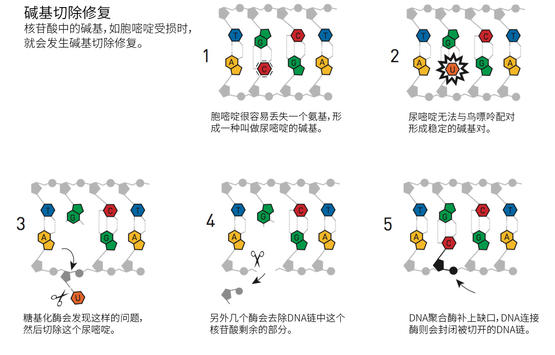
对于托马斯·林达尔而言,关键的一点是意识到了DNA不可避免地会发生变化,哪怕是当分子位于细胞的保护性环境中时也不例外。但是,我们早已知道DNA会因环境因素如UV辐射而受到损伤。而多数细胞用于修复紫外线伤害的机制“核苷酸切除修复”,是被阿齐兹·桑贾尔阐明的,桑贾尔出生于土耳其的萨武尔,活跃于美国研究界。
生物化学比医生更合心意
阿齐兹·桑贾尔对于生命分子开发的痴迷是在伊斯坦布尔攻读医学学位的时候培养起来的。毕业之后,他在土耳其的乡下当了几年的外科医师,但1973年时,他决定学习生物化学。他的兴趣是被一个特别的现象所激发的:细菌暴露在致命的紫外线照射下之后,如果再用可见蓝光照射,它们突然就能死里逃生。桑贾尔对这近乎魔法的反应感到非常好奇,这是一种怎样的化学功能?
一位名叫克劳德·鲁珀特(Claud Rupert)的美国人当时在研究这一现象。于是阿齐兹·桑贾尔加入了他在达拉斯的德克萨斯州大学实验室。1976年,使用当时的粗糙工具,他成功地克隆出能修复被紫外线损伤的DNA的酶——光解酶——的基因,并成功让细菌批量生产这种酶。这成为了他的博士论文,但在当时,并没有引起很多反响。他申请了三次博士后职位,却都遭到了驳回。对于光解酶的研究也被搁置了。为了继续对DNA修复进行研究,阿齐兹·桑贾尔在耶鲁大学医学院(这是业内领先地位的机构)找了个实验室技术员的工作。在这里,他的工作最终让他获得了诺贝尔化学奖。
阿齐兹·桑贾尔:研究细胞如何修复紫外线损伤
当时,人们已经知道细菌有两套修复紫外线损伤的机制:一条系统是依赖光的作用的“光修复”,需要光解酶;另一个系统则可以在暗处发挥作用。阿齐兹·桑贾尔在耶鲁大学的新同事们从二十世纪六十年代中叶开始就开始研究暗修复系统,研究对象是三个对紫外线敏感的细菌突变系,这三个细菌系中分别有不同的基因发生了突变,分别被称为uvrA、uvrB与uvrC。
就像此前对光修复的研究一样,桑贾尔开始探索暗修复的分子机制。只花了几年的时间,他就鉴定、分离与描述了这三个基因编码的酶。在突破性的体外实验中,他证明了这些酶可以发现紫外线伤害的位点,然后在DNA链上切开两个切口,分别发生在紫外损害位点两侧。一段12-13个碱基对的片段,包括损伤位点,就被这样被切掉了。
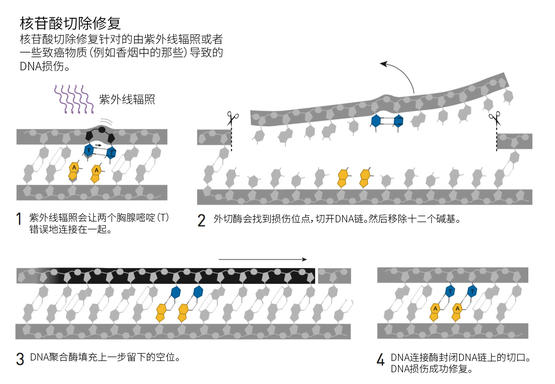
在人类与细菌中,紫外线伤害修复机制是类似的
阿齐兹·桑贾尔从分子水平的细节中获取对这一途径认知的能力改变了整个研究领域。他在1983年发表了他的研究。这样的成就让他获得了北卡罗来纳大学教堂山分校的副教授职位。在那里,他又一次地漂亮地完成了对核苷酸切除修复机制的下一阶段的研究工作。桑贾尔与其他研究人员——包括托马斯·林达尔——同时进行着人类中的核苷酸切除修复的研究。在人体中,紫外线损伤修复的机制远比细菌中的程序复杂,但是从化学上来说,所有有机体里的核苷酸切除修复都是类似的。
然后,桑加尔最初感兴趣的光修复又怎样了呢?最后他还是回到了光解酶,找到了它“复活”细菌的机制。另外,他还证明,人类中相应的酶帮助我们建立了生物钟。
是时候讨论保罗·莫德里奇的工作了。他也是从关于基因修复机制的模糊概念出发,从中雕琢出了美妙的分子细节。
“DNA那套东西”真的很有用
保罗·莫德里奇在美国新墨西哥北部的一个小城镇长大。当地多种多样的广袤风景激发了他对大自然的兴趣。但是有一天,他的教生物的父亲说:“你应该研究一下DNA那套东西。”那是在1963年,詹姆斯·沃森和弗朗西斯·克里克因发现DNA结构而获得诺贝尔奖的第二年。
几年后,“DNA那套东西”真的成为了保罗·莫德里奇生活的中心。在他研究生涯的早期,在斯坦福做博士研究生的时候,在哈佛做博士后的时候,在杜克大学做助理教授的时候,他检验了一系列作用于DNA的酶:DNA连接酶,DNA聚合酶,限制性内切酶Eco RI。随后,当他在20世纪70年代末将注意力转移到Dam甲基化酶时候,他不小心碰到了另一件“DNA那套东西”上,它占据了他科学生涯的一大部分。
两股研究的交织
Dam甲基化酶能够给DNA加上甲基基团。保罗·莫德里奇证明,这些甲基集团可以像路标一样起作用,帮助某个特定的限制性内切酶在正确的位置切断DNA链。但是,就在几年前,马修·梅塞尔森(Matthew Meselson),一位哈佛大学的分子生物学家,认为DNA甲基基团还有另一种信号作用。
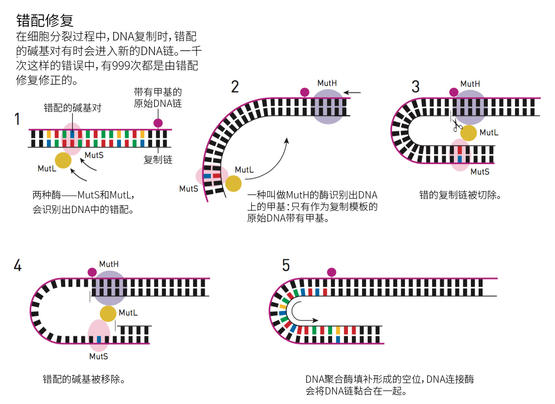
利用一些分子生物学技巧,梅塞尔森改造出了一种噬菌体,它的DNA中有几个不匹配位点。譬如,A(腺嘌呤)对面可能是C(胞嘧啶),而不是它本来应该配的T(胸腺嘧啶)。让这些噬菌体感染细菌,细菌就会修复错误的配对。没人知道细菌为什么有这个功能,但是在1976年,梅塞尔森提出,这可能是因为细菌自己的修复机制,来修复这些有时在DNA复制时出现的错误。如果推测是正确的,梅塞尔森继续推测,可能DNA上的甲基基团帮助细菌确认,纠正的时候哪个是原来的模板,哪个是后来的错误。带有错误的新DNA链还没有甲基化,可能这就是它被识别并修正的方式?
在DNA甲基化的过程中,保罗·莫德里奇和马修·梅塞尔森的道路相交了。两人合作构建了一个具有一系列DNA错配的病毒。这一次,莫德里奇的Dam甲基化酶也被用于在其中一条DNA链上添加甲基。当这些病毒感染细菌时,细菌持续地修正那些未经甲基化的、错配的DNA。莫德里奇和梅塞尔森的结论是,DNA的错配修复是一个天然的过程,在DNA复制过程中,以未甲基化为标志来识别出错的DNA链,修复错配。
保罗·莫德里奇:解释“DNA错配修复”
保罗·莫德里奇的这个发现引发了长达十年的系统性工作——克隆和测定错配修复过程中一个又一个酶。到20世纪80年代末,他已经可以体外重建这套复杂的分子修复机理,并且深入了解它的细节。这项工作在1989年发表。
和托马斯·林达尔、阿齐兹·桑贾尔一样,保罗·莫德里奇也研究了人类版本的修复系统。今天我们知道,在人类基因组复制时产生的所有错误中,只有千分之一逃过了错配修复的法眼。但是,在人类错配修复中,我们仍然不能确切地知道怎么判断哪条链是原本的链。DNA甲基化在我们的基因组中有与微生物中不同的功能,所以,一定是什么别的东西在掌管究竟应该修复哪条链——这个东西是什么还有待查明。
修复系统的缺陷会引发癌症
除了碱基切除修复、核苷酸切除修复和DNA错配修复这三种,还有其他多种机制维护着我们的DNA。每天,它们修复几千起因为日照、吸烟或其他遗传毒性物质导致的DNA损伤;它们不断抵抗着DNA的自发改变。而且,每一次细胞分裂,错配修复都会纠正几千个错配。没有这些修复机制,我们的基因组将会崩溃。其中哪怕只有一个机制失灵了,遗传信息就会很快改变,致癌风险也会增加。比如,核苷酸切除修复如果遭受了先天性损伤,就会导致着色性干皮(xeroderma pigmentosum)病。受这种疾病折磨的人会对紫外线极为敏感,并且在阳光下暴露后会发展为皮肤癌。又比如,DNA错配修复如果有缺陷,会增加了患遗传性结肠癌的风险。
事实上,在很多类癌症中,就是上述一到多个修复体系,被部分地或者全部地被关闭了。这使得癌细胞的DNA变得不稳定,这也是癌细胞经常突变且能够抵抗化疗的原因之一。
同时,这些生病了的细胞会更加依赖还在正常工作的修复体系:没有剩下的这些修复体系,它们的DNA受到的损伤会过于严重,细胞也会死亡。研究者试图利用这种弱点来研发新的抗癌药物。通过抑制残留的修复体系,人们可以减缓或者完全阻止癌症的生长。譬如,奥拉帕尼(olaparib)就是一种可以抑制修复体系的抗癌药物。
总的来说,2015年诺贝尔化学奖得主进行的些基础研究不仅加深了我们对于自身运转方式的理解,而且有助于继续研发可以拯救生命的治疗方法。或者,正如保罗·莫德里奇所言:“这就是为什么我基于好奇心的研究是如此重要。你永远不会知道它会带给我们什么……一点点运气当然也有帮助。”(编辑:Ent)
