对于CRISPR/Cas9基因编辑技术来说,刚过去的2015年是特别的一年。人们利用它“清理”猪基因组中的内源性逆转录病毒;利用它改变人类胚胎的基因序列;甚至将它优化成更精确的基因编辑系统……
伴随越来越多突破,这一技术正在被越来越多的人们接受和认可。如果说在诞生之初,CRISPR/Cas9还只是生物学家的实验工具,到今天,这项技术已经离普通人的生活越来越近。日前,三组研究者在《科学》杂志上发表了同一领域的研究成果:利用CRISPR/Cas9技术,他们对患有杜兴氏肌肉萎缩症(Duchenne Muscular Dystrophy)的小鼠进行了治疗,取得了良好的效果。这是在用CRISPR/Cas9治疗遗传疾病领域跨出的惊人一步。
杜兴氏肌肉萎缩症
肌肉萎缩疾病是困扰人类多年的一类重大疾病。患有这类症状的病人肌肉营养不良,难以行动,代谢紊乱,许多病人寿命很短。
在多种肌肉萎缩症中,杜兴氏肌肉萎缩症可以说是最为凶险的一种——患有这一疾病的病人在12岁左右多会丧失行走能力,骨骼和肌肉发育畸形。随着病情的进展,全身肌肉都会表现出萎缩的症状。而当这种恶变波及心脏和呼吸系统后,往往会造成患者心功能紊乱或呼吸衰竭,最终导致死亡。
遗传因素是造成杜兴氏肌肉萎缩症的主要原因。肌肉在收缩时,需要一种名为Dystrophin的重要蛋白质来保持肌纤维的稳定性,Dystrophin由79个蛋白编码区域组成,其中的任何一个发生突变可能会导致蛋白失去活性。杜兴氏肌肉萎缩症正是由于Dystrophin突变造成的。这一疾病在肌肉萎缩疾病中相对常见,约每3500个男婴中就有一例杜兴氏肌肉萎缩症患儿。
杜兴氏肌肉萎缩症发病的频率和严重程度,使其成为医学研究的重要课题。然而直到今天,对这一疾病,人们仍未有很好的治疗方案。而CRISPR/Cas9的问世,也许会带来新的曙光。
CRISPR/Cas9立功
由一小段模板RNA和核酸内切酶Cas9蛋白组成的CRISPR系统,源于细菌对病毒的免疫机制。2013年,科学家将这个系统从细菌身上“借用”到实验室用于对基因的定向编辑。两年的时间中,许多研究小组在不同的物种中应用和改良了这一系统,最终使得其成为了一种高效而精确的基因编辑方式。
在对杜氏肌肉萎缩症小鼠模型进行的治疗尝试中,三个不同的研究小组使用了一种被称为腺相关病毒(adeno-associated virus,AAV)的无毒病原体,将基因编辑所需的元件送入小鼠体内进行表达。借助CRISPR/Cas9系统的力量,研究人员能够“移除”发生变异的编码区域,恢复Dystrophin蛋白的正常功能。这一治疗思路被证明是有用的。研究人员发现,患病小鼠体内Dystrophin蛋白恢复了表达。
杜克大学查尔斯·格斯巴赫(Charles A. Gersbach)小组的研究成果表明,相比治疗前,约有60%的肌纤维蛋白能够恢复表达这一蛋白的能力[1]。小鼠的肌萎缩症状也得到了相当程度的缓解。
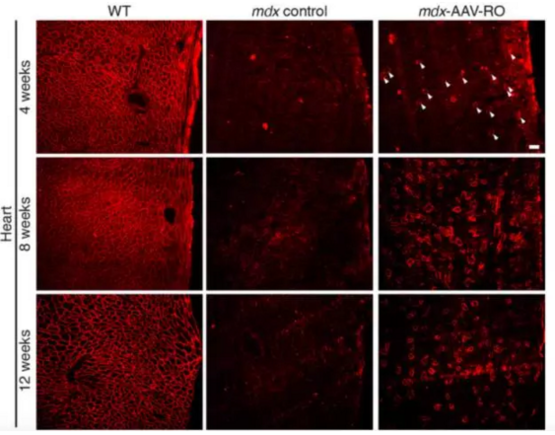 另一小组,德克萨斯州西南医学中心埃里克·奥尔松(Eric N. Olson)团队也成功缓解了患病小鼠的症状。这一治疗是经由CRISPR/Cas9恢复肌纤维细胞表达Dystrophin的能力得以实现的。研究人员利用红色荧光染料标记Dystrophin。在野生型小鼠(左列)的心肌细胞中,这一蛋白大量表达,但在患病鼠(中列)中,该蛋白表达几乎消失。而在接受CRISPR/Cas9基因治疗的小鼠(右列)中,随着治疗时间的推移,肌细胞中Dystrophin的表达正在逐渐的恢复。图片来源:参考文献[2]
另一小组,德克萨斯州西南医学中心埃里克·奥尔松(Eric N. Olson)团队也成功缓解了患病小鼠的症状。这一治疗是经由CRISPR/Cas9恢复肌纤维细胞表达Dystrophin的能力得以实现的。研究人员利用红色荧光染料标记Dystrophin。在野生型小鼠(左列)的心肌细胞中,这一蛋白大量表达,但在患病鼠(中列)中,该蛋白表达几乎消失。而在接受CRISPR/Cas9基因治疗的小鼠(右列)中,随着治疗时间的推移,肌细胞中Dystrophin的表达正在逐渐的恢复。图片来源:参考文献[2]
哈佛大学的艾米·维杰斯(Amy J. Wagers)则用延时成像技术记录下了原本罹患肌萎缩的小鼠的肌卫星细胞在经过基因修正后在培养基中形成肌小管的过程[3]。他们发现,基因编辑重建了部分肌卫星细胞中正常Dystrophin的表达。不过,克里克研究所的遗传学教授罗宾·洛弗尔-巴奇(Robin Lovell-Badge)评论称:“由于在心脏中不存在与骨骼肌的肌卫星细胞等效的、可以形成心肌细胞的干细胞群,我们必须寻找其他方式来提高对这一组织的编辑效率。”
 在经过基因编辑后,被红色荧光蛋白标记的肌卫星细胞形成多核的肌小管。图片来源:Mohammadsharif Tabebordbar
在经过基因编辑后,被红色荧光蛋白标记的肌卫星细胞形成多核的肌小管。图片来源:Mohammadsharif Tabebordbar
2013年,发明CRISPR/Cas9系统的华裔科学家张锋入选《自然》杂志年度十大人物。在接受采访时,他表示希望这一技术最终能够用于人类基因的编辑,并进行遗传疾病的治疗。现在,这三组研究者的这些努力正在使这一期许逐步变为现实。
虽然目前的研究只是对小鼠进行的,要走向临床试验,还需要做相当大量的工作。英国皇家兽医学院肌肉骨骼生物学教授多米尼克·威尔斯(Dominic Well)评论:“AAV载体能否在人体内有效传递尚未得到证明。同时,CRISPR/Cas9系统也有潜在的脱靶可能性。尽管目前的研究展示了基因编辑技术在治疗DMD上的潜能,但在考虑临床应用前,我们仍需进行许多进一步研究。”
不过,作为CRISPR/Cas9又一个里程碑式的突破,这个研究结果依旧向许多人提供着说服力十足的鼓舞:在生命科学发展如此迅猛的今天,我们所期待的未来,大概并不遥远。
(编辑:Calo)
参考文献:
- Nelson et al. In vivo genome editing improves muscle function in a mouse model of Duchenne muscular dystrophy. Science DOI: 10.1126/science.aad5143
- Long et al. Postnatal genome editing partially restores dystrophin expression in a mouse model of muscular dystrophy. Science DOI: 10.1126/science.aad5725
- Tabebordbar et al. In vivo gene editing in dystrophic mouse muscle and muscle stem cells. Science DOI: 10.1126/science.aad5177
