除了人类以外 ,还有一个庞大而“微小”的族群。对于它们来讲,电与互联网是生存与信息传播的利器。
这个族群就是微生物。它们的“电子互联网”世界被人类知晓源于“电缆细菌”的发现。
谁最先使用了“电线”?
事情起源于一次偶然的发现。一群科学家在海洋沉积物的内部,发现了强烈的硫化物氧化的现象。
硫化物是还原性比较强的物质,微生物可以在有氧气或硝酸盐存在的条件下,将硫化氢氧化硫酸盐或硫。然而问题在于,在沉积物中氧气与硝酸盐都是很容易被消耗的“资源”,难以长期留存。究竟是什么原因导致沉积物中的硫化物被不断的氧化呢?之后,在其他很多海洋与河流、湖泊环境中的沉积物也相继发现了类似的现象。
研究者们设计了一系列的实验去探究其原因。在排除了物理、化学的作用之后,人们最终聚焦于从沉积物内部长出来的丝状物身上。
这些丝状物由Desulfobulbaceae科的微生物构成,它们以头尾相接的方式组成一条直径约为1个细胞、长度为几千个细胞的线性结构,一头伸出沉积物连接大气,一头扎入沉积物中锁定硫化物。在空气中的一头负责呼吸氧气,同时将呼吸过程所产生的电子收集起来转输到底层,为沉积物中的氧化还原反应提供电子。
 海洋中电缆细菌的示意图(图中: SO42-,H2S,S分别为硫酸根离子、硫化氢与硫元素,O2与H2O为氧气与水分子。图来来源:文献[3]
海洋中电缆细菌的示意图(图中: SO42-,H2S,S分别为硫酸根离子、硫化氢与硫元素,O2与H2O为氧气与水分子。图来来源:文献[3]
这种转移电子的结构可以说是名副其实的“活体电缆”,所以这些微生物也被称为“电缆细菌(Cable bacteria)”。“电缆细菌”的偶然发现让人们见识到,微生物不但在使用电,还用自己的身体铺设属于它们的电缆,有组织地定向传播电子。研究者称这种现象为种间电子传递(Direct interspecies electron transfer ,DIET)[1]。
电缆细菌进行“超长距离”电子传输的历史恐怕比人类世界利用“电缆传输电能”的历史要久远得多。而电缆细菌的发现,让人们第一次窥探到微生物群体间存在的电互联网世界。
友军之间的导电通道?
“有福同享”是生物界常见的现象,电缆细菌通过搭线与同类的同伴共享电子,而某些不同种属的微生物之间则是通过一些辅助工具完成所需要的物质与电子的传递。
下面这个故事发生在脱硫弧菌(Desulfovibrio vulgaris)与梭状芽孢杆菌(Clostridium acetobutylicumand)之间。
一般来说,脱硫弧菌的“食物”是硫酸盐,当缺乏硫酸盐时脱硫弧菌的生长会变得十分缓慢。但奇怪的是,只要与梭状芽孢杆菌一同培养,就算缺少了硫酸盐,脱硫弧菌也能够正常的快速生长。难道说是梭状芽孢杆菌代替了硫酸盐吗?
硫酸盐为脱硫弧菌提供其生长所需的电子受体,在共同培养的情况下,梭状芽孢杆菌恰恰能够成为电子受体的提供者。
脱硫弧菌内有一种铁氧蛋白(ferrodoxin)可以作为电子携带载具,在脱硫弧菌与梭状芽孢杆菌间来回传递。于是,在梭状芽孢杆菌体内被氧化的铁氧蛋白进入脱硫弧菌中,代替硫酸盐与脱硫弧菌进行还原反应,为脱硫弧菌提供电子受体[4]。这两种细菌之间传输电子的通道是一种叫做“生物纳米管”(Biological nanotubes)的结构。
生物纳米管是一种比人的头发丝还要细1万倍的微小管道,可用于电子与小分子物质的传递。虽然比不上电缆细菌的电子传递速率与传输的距离,但在传递物质的选择性与速度方面却比一般的方式(比如细胞间传递、物理扩散等)更快[5]。这一传递电子与物质信号的绿色通道大大拓宽了不同种微生物间合作的便利。
除了脱硫弧菌和梭状芽孢杆菌,斯瓦希菌(Shewanella oneidensis)、芽孢杆菌(Bacillus subtilis)等细菌的细胞表面都发现类似的“生物纳米管道”的结构,但这些纳米管的功能和广泛性还需要更多研究去证实[6]。
 生物纳米管(Biological nanotubes)互联示意图(来源于文献13,有修改)
生物纳米管(Biological nanotubes)互联示意图(来源于文献13,有修改)
除了生物纳米管,微生物之间还会通过一种叫细胞色素C(c-type cytochromes)的生物蛋白来传递电子。
比如在海洋环境中存在大量分解甲烷与硫化合物的甲烷氧化古菌(methane-oxidizing ANME-2 archaea )与硫酸还原菌(sulfate reducers bacteria,SRB),这两种菌经常聚集在一起形成活性很强的且具有导电能力的微生物团[7]。在这些微生物团的结构中,就有细胞色素C大量存在着[8]。
细胞色素C具有高效的电子传递的功能,能够在微生物团的内部与周边环境中高效的传递电子。当甲烷被古菌转化的时候会产生大量的电子,细胞色素C可以作为导线将电子从古菌的内部往外周传递出去,硫酸盐还原菌就在外周接受传递来的电子,用于完成硫酸盐还原的代谢过程。通过导电物质的帮忙,电子传递同样可以跨过微米的传输距离,全方位的完成电子的传输。
 细胞色素互联示意图(来源于文献13,有修改)
细胞色素互联示意图(来源于文献13,有修改)
用身体的一部分当导线?
微生物电子互联网的故事远还没结束,细菌还会利用自己的菌毛(e-pili)构建微生物电子互联网,这种方法更为简洁高效。导电菌毛的出现提供了微生物们隔空捕捉与传递电子的能力。地杆菌属的G.metallireducens与 G. sulfurreducens在共培养的时候,前者转化乙醇为乙酸获取能量、产生电子,而后者则伸出“导电”的菌毛与前者接触,获得电子支持其生长[11]。大量的e-pili纵横交错,将两者联结在一起,是名副其实的电子互联网。虽然彼此并不相近,但也可以在电子互联网中互相支持,互通有无[12]。e-pili互联网的互作共生现象,展示了微生物间复杂的电子传递互联网体系,电子不仅从一个方向传递到另一个方向,还能发散至网络所触及的各个角落,实现微生物间信息、电子的实时互通,活脱脱的“电子互联网加”版本。
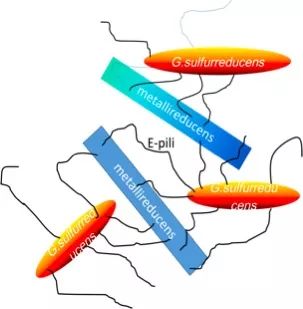 epili互联网示意图(来源于文献13,有修改)
epili互联网示意图(来源于文献13,有修改)
用电子互联网创造生命
“欲穷千里目,更上一层楼”,站得越高,伸得更长,当然在激烈的竞争中越有优势。微生物们似乎也懂得这般道理。无论是电缆细菌的贯穿天地般的定向互联,还是纳米管、细胞色素的就地取材局域网传递,又或者是e-pili的互联网加强版,都显示这些单细胞生物不再是单打独斗或靠量取胜,他们拥有远比我们设想复杂的生存策略与联系方式。
就如电能驱动的人类社会,通过互联网交换信息与提高生产力,微生物们也许正是通过看得见或看不见的方式组成庞大的互联王国,悄悄的在网中共享电子资源,共享环境信息,获得生存的力量。我们用电与互联网改变世界,而他们用电子互联网创造生命。(编辑:婉珺)
参考文献:
- Pfeffer C, Larsen S, Song J, Dong M, Besenbacher F, Meyer RL et al. (2012). Filamentous bacteria transport electrons over centimetre distances. Nature 491: 218–221.
- Nielsen LP, Risgaard-Petersen N. (2015). Rethinking sediment biogeochemistry after the discovery of electric currents. Ann Rev Mar Sci 7: 424–442.
- Pfeffer, Larsen, Song, Dong, Besenbacher, Meyer, Kjeldsen, Schreiber, Gorby, El-Naggar, Leung, Schramm, Risgaard-Petersen & Nielsen. 2012. Filamentous bacteria transport electrons over centimetre distances.
- Benomar S, Ranava D, Cardenas ML, Trably E, Rafrafi Y, Ducret A et al. (2015). Nutritional stress induces exchange of cell material and energetic coupling between bacterial species. Nat Commun 6: 6283.
- Pande S, Shitut S, Freund L, Westermann M, Bertels F, Colesie C et al. (2015). Metabolic cross-feeding via intercellular nanotubes among bacteria.
- Dubey GP, Mohan GBM, Dubrovsky A, Amen T, Tsipshtein S, Rouvinski A et al. (2016). Architecture and characteristics of bacterial nanotubes. Dev Cell 36: 453–461.
- McGlynn SE, Chadwick GL, Kempes CP, Orphan VJ. (2015). Single cell activity reveals direct electron transfer in methanotrophic consortia. Nature 526: 531–535.
- Scheller S, Yu H, Chadwick GL, McGlynn SE, Orphan VJ. (2016). Artificial electron acceptors decouple archaeal methane oxidation from sulfate reduction. Science 351: 703–707.
- Malvankar NS, Tuominen MT, Lovley DR. (2012b). Lack of involvement of c-type cytochromes in long-range electron transport in microbial biofilms and nanowires.Energy Environ Sci 5: 8651–8659.
- Vargas M, Malvankar NS, Tremblay P-L, Leang C, Smith JA, Patel P et al. (2013). Aromatic amino acids required for pili conductivity and long-range extracellular electron transport in Geobacter sulfurreducens. MBio4: e00105–e00113.
- Summers ZM, Fogarty H, Leang C, Franks AE, Malvankar NS, Lovley DR. (2010). Direct exchange of electrons within aggregates of an evolved syntrophic co-culture of anaerobic bacteria. Science 330: 1413–1415.
- Shrestha PM, Rotaru A-E, Summers ZM, Shrestha M, Liu F, Lovley DR. (2013b). Transcriptomic and genetic analysisof direct interspecies electron transfer. ApplEnviron Microbiol 79: 2397–2404.
- Lovley DR.(2016). Happy together: microbial communities that hook up to swap electrons.The ISME Journal :1–10.
