感谢器官移植技术的发展,器官衰竭病人有了延长生命的新希望。然而数十年以来,器官资源的短缺一直是移植手术绕不开的话题。中国是全球器官捐献率最低的国家之一,而在美国,平均每天亦有22位病人在等待器官移植中死去。可移植器官的大量缺乏不仅使得人们难以负担等待过程中的治疗费用,由此衍生的黑市交易也带来了更多的社会问题。
生物学家一直致力于寻找移植用器官的替代资源,人捐的器官不够用,用其他动物的怎么样呢?你可能马上会想到非人灵长类。可惜这些人类近亲们要不是已经濒危,就是器官大小与人类相距太远。生物学家认为理想的器官供体应该源自一种经过长期驯化的动物,而它们的器官又恰好要与人体器官体积相似。在众多动物中,家猪脱颖而出了。
不过,猪毕竟不是人,异种器官移植需要解决各种各样的安全问题。猪基因组中携带的猪内源性逆转录病毒(porcine endogenous retroviruses, PERVs),就是其中一个备受关注的潜在威胁。这些病毒能够将自己的基因整合在猪基因组各处,可能进而感染人类细胞。想要利用猪器官,科学家们就必须解决这一问题。
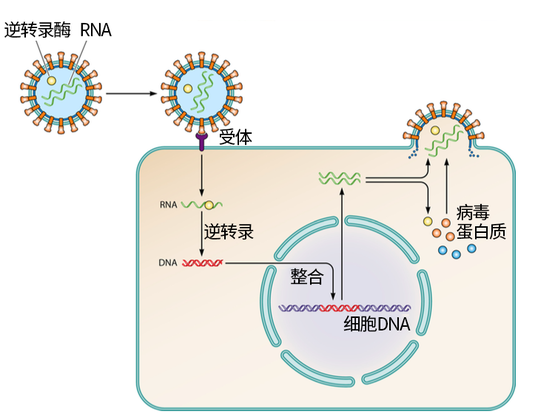 猪内源性逆转录病毒(PERV)的生活史示意图。这些病毒能将自身的基因整合到猪细胞的基因组中,并利用猪细胞的资源制造病毒蛋白质。图片来源:参考文献[1]
猪内源性逆转录病毒(PERV)的生活史示意图。这些病毒能将自身的基因整合到猪细胞的基因组中,并利用猪细胞的资源制造病毒蛋白质。图片来源:参考文献[1]
近日,哈佛大学乔治·彻奇(George Church)的研究小组取得令人欣喜的进展:利用CRISPR/Cas9基因编辑技术,他们成功地在猪基因组中使这些病毒基因失效。这一成果近日发表在《科学》上[2]。
CRISPR/Cas9是什么?
CRISPR/Cas9是一套非常厉害的“编辑器”,由内切酶Cas9和一条“导向RNA”(guide RNA)组成。导向RNA像粘扣带一样跟目标DNA结合上之后,Cas9会挪到目标区域把DNA链减短。在DNA修复机制把断掉的DNA连上之前加入新的一段模板序列,被修复的基因就带上了研究者设计的DNA。这样,人们就可以依据自己的需要改变某些基因的序列。
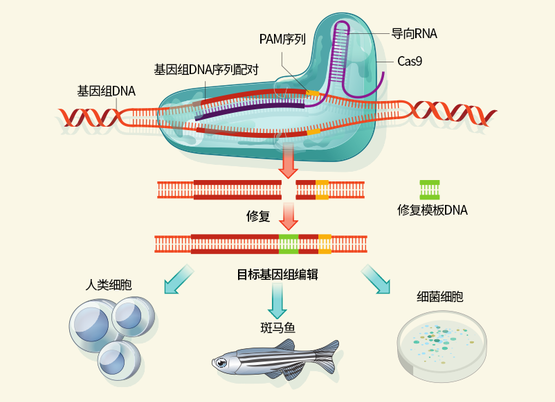 CRISPR/Cas9技术的工作原理。导向RNA(Guide RNA)将内切酶Cas9蛋白引导至基因组上需要编辑的区域,内切酶会在基因组上切除缺口,此时DNA修复系统会根据携带突变的修复模板(Donor DNA)进行修复,最终将突变序列(Indel)引入基因组造成基因失活。目前这一技术已经被广泛用于多种生物的基因编辑。图片来源:参考文献[3]
CRISPR/Cas9技术的工作原理。导向RNA(Guide RNA)将内切酶Cas9蛋白引导至基因组上需要编辑的区域,内切酶会在基因组上切除缺口,此时DNA修复系统会根据携带突变的修复模板(Donor DNA)进行修复,最终将突变序列(Indel)引入基因组造成基因失活。目前这一技术已经被广泛用于多种生物的基因编辑。图片来源:参考文献[3]
2013年,当30岁的神经生物学家张锋首次利用这种系统进行细胞基因编辑实验时,他可能不会想到这一技术能在多大程度上改变这个世界的面貌。近两年来,CRISPR/Cas9技术被广泛用于各个物种的基因编辑。从对常见模式生物(如大肠杆菌或小鼠)的基因编辑,到更为广泛的遗传疾病治疗研究,这一技术正在生命科学领域引起极为深刻的影响。
破纪录的尝试:批量编辑62处基因
那么,乔治·彻奇和同事们做了什么?
所谓擒贼先擒王,要消灭这些猪病毒,可以针对它的一个关键基因:pol。这个基因编码一种逆转录酶,让病毒能够藏进其他物种的基因组里。这个基因狡猾得很,在一种猪肾上皮细胞里,它足足在基因组中留了62套备份。要挨个消灭它们,太麻烦了。
好在研究者也有妙招:这个基因太重要了,容不得乱改,所以不管有多少份,都差不多一样。利用前面说到的编辑器,彻奇和同事专门针对这个基因设计了一枚定向导弹(也就是一条合适的导向RNA),试图一口气消灭一大片。
这个史无前例的大规模编辑成功了。在实验中,在约10%的细胞中,97%-100%的pol基因都被这研究者的导弹轰成了渣——用这样的猪肾细胞去感染人肾细胞,病毒的感染效率被削弱了近1000倍,几乎没有了惹事的能力。
而由于CRISPR/Cas9的打击非常精确,经过确认,这番声势浩大的修改并没对目标区域以外的基因组产生任何影响。
这一步成功了,但在前面等着的难题还多得很
虽然并没有足够证据证明PERV这种病毒会对人类造成严重影响,但确保我们具备消除这种潜在威胁的能力,无疑更令人放心。乔治·彻奇和同事们令人惊喜的研究成果,让人们在利用猪器官作为器官供体的道路上前进了一大步,
当然了,我们离最终的目标还很遥远。由于目前还没有可用于培养的猪胚胎干细胞,想要利用这一研究成果却繁殖不携带这种病毒的猪,人们还需要借助克隆技术。遗传学家可以分离出经过编辑的细胞核,并将它们重新植入猪受精卵中。可想而知,这样复杂的操作必然会增加制备器官供体的成本。更别说排异反应还在更远的地方等着。但值得庆幸的是,全球科研人员在此方向上的努力,一刻都没有停止。
 也许在不远的未来,它们将成为安全便利的器官供体,去拯救千万人的生命。图片来源:shutterstock友情提供
也许在不远的未来,它们将成为安全便利的器官供体,去拯救千万人的生命。图片来源:shutterstock友情提供
(编辑:Calo)
参考文献:
- Denner, Joachim, and Ralf R. Tönjes. "Infection barriers to successful xenotransplantation focusing on porcine endogenous retroviruses." Clinical microbiology reviews 25.2 (2012): 318-343.
- Luhan Yang. et al. "Genome-wide inactivation of porcine endogenous retroviruses (PERVs)." , Science (2015) DOI: 10.1126/science.aad1191
- Charpentier, Emmanuelle, and Jennifer A. Doudna. "Biotechnology: Rewriting a genome." Nature 495.7439 (2013): 50-51.
