父母生育子女的年龄对后代的影响一直是人们所关注的话题之一。不久前,来自冰岛大学的Hákon Jónsson及其同事发表在《自然-遗传学》(Nature Genetics)上的一项相关研究[1]得出了如下结论:从基因组水平来讲,父母生育后代时的年龄越大,子女遗传物质中出现新生突变的概率就越高。
新生突变(de novo mutation,DNMs),指出现在后代基因组中的、由父母一方精子/卵子中遗传物质突变导致一个家族中首次出现的基因变化。为了解父母的年龄和性别是如何影响新生突变的,研究者采集了14,688名冰岛人(样本人群构成如图1)的血液或口腔细胞样品,并对样品中的遗传物质进行了全基因组测序分析。
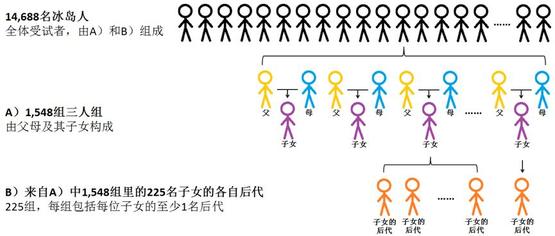 图1.实验样本人群构成。制图:复制黏贴火柴人上瘾的白鹿风
图1.实验样本人群构成。制图:复制黏贴火柴人上瘾的白鹿风
随父母生育年龄变化,源自父系的新生突变年增长数量是源自母系的四倍
测序识别出了包括单核苷酸多态性(single nucleotide polymorphisms,SNP)、核苷酸插入/缺失在内的共108,788个新生突变,即受试的1548个家族的“基因平均突变率”为70.3个/家族。
从新生突变数量角度,研究者发现,以225组祖孙三代样本作为研究群体时,源自母亲的新生突变数量岁随母亲年龄的增长每年增加0.37个,而源自父亲的新生突变数量是前者的四倍,随父亲年龄的增长每年增加1.51个(图2-中);同样,以1,584组父母-子女三人组样本为研究群体时,也显示出了类似的趋势(图2-右)。
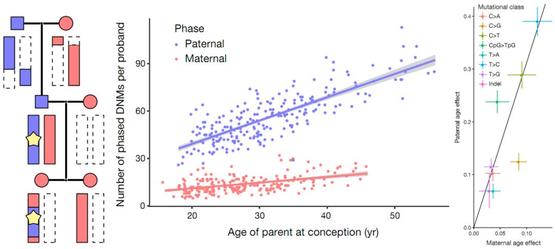 图2.左图|判断某突变为新生突变的依据:新生突变(星星图案)在三代人的第二代中出现,随父方(蓝色)染色体遗传至第三代。
图2.左图|判断某突变为新生突变的依据:新生突变(星星图案)在三代人的第二代中出现,随父方(蓝色)染色体遗传至第三代。
中图|后代基因组中新生突变数量与父/母生子时年龄的函数关系,随父亲年龄增长产生的父方遗传新生突变数量(蓝色)是相应母方遗传(红色)中的四倍(研究群体为225组祖孙三代样本)。横轴:父/母生子时的年龄;纵轴:后代基因组中的新生突变数量。
右图|不同突变类型各自的父方(纵轴)/母方(横轴)遗传随年龄增长的变化率的对比(研究群体为1,584组父母-子女三人组样本),父方随年龄的突变率整体约为母方的3.1倍,两个例外分别是CpG>TpG突变(比率偏高,父方:母方≈6:1)和C>G突变(比率偏低,父方:母方≈1:1)。
图片来源:参考文献[1]
染色体上的聚类突变随母方生育年龄变化产生了更大的变化幅度
虽然对新生突变的整体数量来说,随着年龄的增加,源自母亲的突变数量的增加量比来自父亲的突变数量的增加量小,但这是整体上的基因突变率。相比之下,聚类突变(clustered mutation,在一小段基因簇中同时出现的多个新生突变)的分布情况则并非如此。
研究人员接下来详细的研究了一下这些与生育年龄相关的新生突变在染色体中的位置,发现它们并不是均匀分布在整个基因组里的,而是更密集地分布在基因簇里(基因簇,gene cluster,分布在生物基因组中,呈现两个或以上较紧密排列并编码相似生物功能的基因集合)。
与父亲相比,母亲年龄的增长会让聚类新生突变产生更大的增幅,这些突变出现在基因组上的位置跨度也更大,突变类型也会产生较大幅度改变。
之前的多个针对人类家系的突变相关研究中,科学家就频繁的观察到了碱基C突变为碱基G(C>G突变)的大量聚类突变[2,3]。C>G突变通常源于母方遗传。
在这次研究中,Jónsson等人也发现了与过去的研究(如1,000基因组项目)一致的突变趋势——例如在人类8号染色体短臂起始端一个大小为20 兆(Mb)碱基的区域中,来自母亲的新生突变的出现密度是全部染色体中出现新生突变的平均密度的4.5倍(图3a,b),其中碱基C>G的突变更是基因组其余部分的50倍(图3c,d)。在C>G突变密集的染色体区域内,有56.5%的C>G新生突变簇出现来自母亲,相应来自父亲的仅为8.8%,印证了此种突变通常源于母亲一方遗传的说法,同时也发现来自母亲的变异生成的基因簇片段的长度整体长于来自父亲的变异生成的基因簇(图4)。
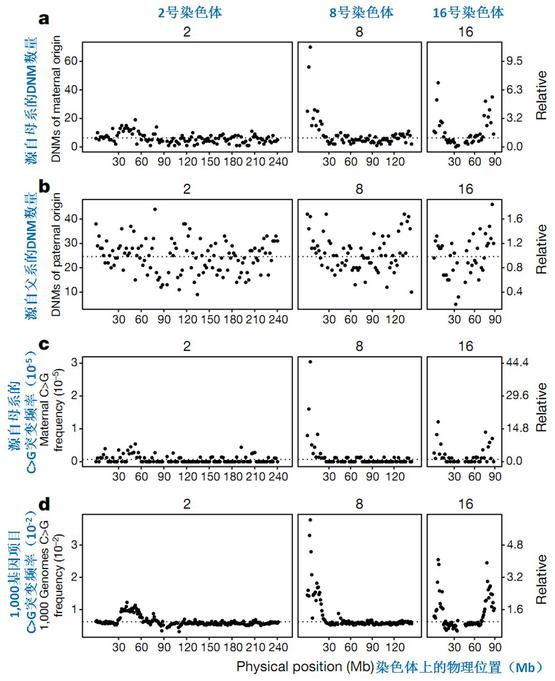 图3.以人类2号、8号(本研究中主要关注的染色体)和16号染色体为例,展示新生突变在染色体上的分布。
图3.以人类2号、8号(本研究中主要关注的染色体)和16号染色体为例,展示新生突变在染色体上的分布。
图a,b|本研究中母方和父方新生突变在不同染色体上的数量(分析滑动窗口大小2 Mb)。
图c,d|本研究中母方遗传C>G新生突变发生频率(分析滑动窗口大小2 Mb)和“1000基因组项目”C>G新生突变发生频率(分析滑动窗口大小1 Mb)。
横轴代表的物理位置上,黑点在纵轴上的位置高,表明相应区域的突变数量多/突变频率高,如图a:2号染色体上母方遗传新生突变数量在整条染色体上分布较均一,黑点分布整体平缓;8号染色体起始端母方新生遗传突变数量非常高,黑点在初始位置十分高然后缓慢降低;16号染色体的母方遗传新生突变数量在染色体的部分位置有高密度分布,相对应的黑点起伏差别也较大。
图片来源:参考文献[1]
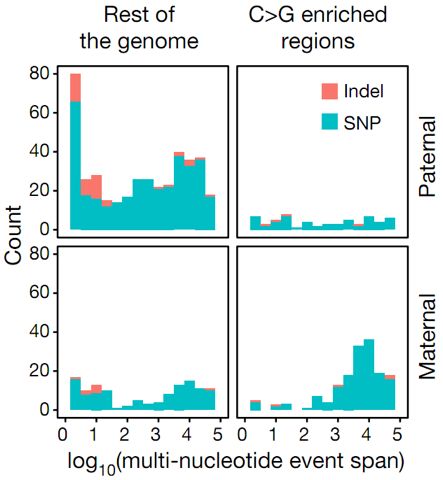 图4.父方遗传(上半图)和母方遗传(下半图)产生的新生突变簇(红色:核苷酸插入/缺失;青色:单核苷酸多态性)在其他区域(左半图)中和基因组C>G密集突变区(右半图)的分布。
图4.父方遗传(上半图)和母方遗传(下半图)产生的新生突变簇(红色:核苷酸插入/缺失;青色:单核苷酸多态性)在其他区域(左半图)中和基因组C>G密集突变区(右半图)的分布。
横轴:基因簇片段长度(log10);纵轴:新生突变数量。右下图显示在C>G密集突变区中,与相应的父系数据相比,源于母系的新生突变簇,尤其是长突变簇的数量更多。
图片来源:参考文献[1]
与古人类和灵长类物种基因组的对比
研究者们还进一步对比了现代人与古人类(archaic hominins)以及其他灵长类物种的染色体。现代人与古人类基因组的对比表明古人类基因组中相应的染色体上也具有类似的C>G突变趋势。这种突变过程可能已经在人类基因组中发生并持续了数千年。
现代人类与其他灵长类动物的对比则表明,人类与黑猩猩共享了很多基因组内区域大量的C>G突变趋势,大猩猩次之。相比之下,红毛猩猩的基因组中无明显此变化趋势。这个结果从另一个角度论述了这三个物种与人类,至少是冰岛人,亲缘关系的远近。
 图片来源:维基百科[4-6]
图片来源:维基百科[4-6]
同样的年龄变化之下,父亲和母亲对子女遗传物质中的新生突变数量的影响差异如此巨大,一个可能导致这种差异发生的解释如下:
同为随着年龄老化的细胞,与男性体内不断进行有丝分裂、一直保持“活性”的大量精原细胞相比,只在女性月经周期才开始进一步发育的单个卵母细胞相对来讲缺乏足够多的有丝分裂过程,这可能导致细胞在整体老化期间产生更多的新生突变。
随母亲年龄的增长,后代基因组特定区域中C>G新生突变的增加,则要归因于老化的卵母细胞的一些独特特征。比如在减数分裂染色体交叉期间,对维护染色体结构有长期作用的结构性压力,会因为卵母细胞在老化过程中耗尽粘结蛋白而逐渐衰退,使得卵母细胞中的遗传物质难以维持原本的结构,提高了突变发生的可能性[7]。
了解人类基因组中产生序列多样性的突变过程,对医学、遗传学和进化的相关研究至关重要。突变率是用于校准序列多样性时间量程的关键参数,文中描述的突变现象和突变率可以用来预测人类世代基因突变的长期状态。
整体来讲,在本次研究中,研究人员通过计算,认为父母中父亲方的生育年龄每增长10岁,会导致后代基因变异率平均每年增长4.7%,而母亲方生育年龄同样的增幅则会导致后代基因变异率每年降低9.6%,因为更年长的母亲虽然会导致后代遗传物质中产生更多的突变,但也意味着她们会生出数量较少的的后代,这二者相互抵消,反而导致了母亲方的年龄增长在整体上降低了后代的基因突变率。
基因突变听上去很可怕,但很多突变仅仅是默默发生并存在于生物的遗传物质中,甚至并不会对后代的生理或着身体各方面造成明显的影响。本文中进行的突变相关研究,主要为现代医学遗传学和人类进化相关领域提供了信息支持,和古人类的遗传信息相结合的研究则进一步从进化演变的角度,说明了这样的新生突变其实是自古随时间存在了数千年的一种自然“现象”。人类的序列多样性由年龄、性别、突变类型和基因组位置间的相互作用所形成[8],在对物种演变时的突变率进行解读和预估时,上述这些因素也应该被纳入考虑,忽略需谨慎。(编辑:明天)
参考文献:
- Jónsson, H. et al. Parental influence on human germline de novo mutations in 1,548 trios from Iceland. Nat. Genet. (2017)
- Francioli, L. C. et al. Genome-wide patterns and properties of de novo mutations in humans. Nat. Genet. 47, 822–826 (2015).
- Besenbacher, S. et al. Multi-nucleotide de novo mutations in humans. PLoS Genet. 12, e1006315 (2016).
- By Thomas Lersch - Own work, CC BY 2.5, https://commons.wikimedia.org/w/index.php?curid=1001910
- By Brocken Inaglory - Own work, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=7283971
- By Eleifert - Own work, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=3913620
- Herbert, M., Kalleas, D., Cooney, D., Lamb, M. & Lister, L. Meiosis and maternal aging: insights from aneuploid oocytes and trisomy births. Cold Spring Harb. Perspect. Biol. 7, a017970 (2015).
- Amster, G. & Sella, G. Life history effects on the molecular clock of autosomes and sex chromosomes. Proc. Natl Acad. Sci. USA 113, 1588–1593 (2016).
