(王劈柴/编译)国际纯粹与应用化学联合会(IUPAC)正式宣布,元素周期表中将加入4个新元素——原子序数分别为113、115、117和118。
这可是件大事,因为这四个元素——都在实验室合成,放射性强,还特别重——补齐了元素周期表的第七行。它们的发现也为科学家在未来合成更重、(或许)有实用价值的元素提供了可能。
下面,我们来解读一下这一发现的意义(我是说,除了纹了元素周期表纹身的人现在已经过时了之外的意义。)
这四个元素在自然界不存在
每个元素都有一个原子序数,与原子核中的质子数相对应。氢的原子核中有一个质子,它的原子序数是1。2号元素氦有两个质子。
这些新元素的质子数分别是113、115、117和118。包含这么多质子的原子极不稳定,无法存在于自然条件下。这是因为质子之间是相互排斥的。在较小的原子中,质子之间靠强核力粘结在一起——核弹爆炸释放的就是这种强大的能量。但在较大的原子中,强核力不足以维持原子核,这些原子将会衰变成质子更少、更稳定的元素。(有92个质子的铀是自然界存在的最重的元素)
如何创造更重的新元素?让轻元素的原子互相撞
制造原子序数特别高的元素只能靠撞击两个较轻的原子,默默希望它们的质子能黏在一起。
“为了制造117号元素,”《科学美国人》杂志解释说,“研究者用钙核(每个原子核拥有20个质子)撞击靶核锫核(每个原子核拥有97个质子)。”但实际过程比听上去更难。锫元素(以加州伯克利市命名)极其稀有;该团队用了超过两年时间才收集到13毫克锫用于实验。
一旦被制造出来,117号元素就几乎立刻衰变消失了。它的半衰期(一定量原子中的一半发生衰变所用的时间)只有五万分之一秒。由锌离子与铋撞击产生的113号元素也很短命:据它的日本发现者报告,它的半衰期只有不到一千分之一秒。
需要说明的是,这些元素并不是刚刚发现的。科学家们几年前就在实验室里找到了它们存在的证据。但IUPAC有一套冗长的认证程序。
发现新元素有什么意义?
那么,我们为什么要证明这些极易消失,而且没什么明显实用价值的元素存在呢?其一,因为我们能。用观察数据证实科学理论很重要。这让我们基于元素周期表所做的预测更为可信
其二,因为在未来的某一天,我们也许能造出一些非常重、非常有用的新元素。
量子理论推测,制造出特别重——拥有超过120个质子——同时还很稳定(不易衰变)的元素是可能的。这些元素可能存在于元素周期表尽头的“稳定岛”,没人知道它们具有什么性质。
这些新元素叫什么?
IUPAC将115、117和118号元素的发现归功给了一支来自俄罗斯和美国的合作团队,将113号元素的发现归功给了一支日本团队。“对科学家来说,这比奥林匹克金牌更有价值,”诺贝尔奖获得者野依良治向卫报解释道。发现者可以给这个元素命名。
“新元素可以根据神话形象、矿石、地名或国名、某一所有物或科学家来命名,在最终确定新的官方名称和符号之前会公示五个月时间。”Science Alert报道。
-
元素周期表快速复习
这是一张元素周期表,它描述了宇宙中所有已知元素的重量和化学性质。
 一张第七行没有补全的过时元素周期表。图片来源:Wikipedia
一张第七行没有补全的过时元素周期表。图片来源:Wikipedia
元素周期表一般遵循以下规则(但也有很多例外)。
同一周期的元素从左到右:
-
由轻变重;
-
金属性逐渐减弱,非金属性逐渐增强;
-
正电性逐渐减弱,负电性逐渐增强,最右显惰性(既不带正电也不带负电)
周期表的天才之处在于,发明者德米特里•门捷列夫发现,随着元素质量的增加,这一模式会重复出现。每当模式重复,周期表就增加一行。
通过元素周期表,人们可以很容易地浏览各元素的质量,以及猜测表中各元素间会发生什么反应。所以我们知道,尽管钾(K)的质量几乎是钠(Na)的两倍,但二者在化学上表现得极为相似,并以此类推。
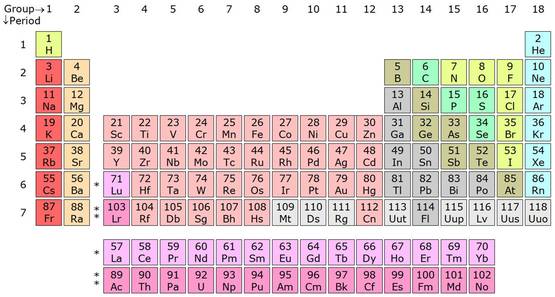 最新版元素周期表——当然,113、115、117、118四种元素还没来得及命名。图片来源:Wikimedia
最新版元素周期表——当然,113、115、117、118四种元素还没来得及命名。图片来源:Wikimedia
(编辑:Ent)
