“造就这星球上全部有知觉的生命,演化只用了一种工具:错误。”——罗伯特·福特《西部世界》
 电视剧《西部世界》中的主要人物在谈及演化时强调了“错误”的力量。图片来源:magicalquote.com
电视剧《西部世界》中的主要人物在谈及演化时强调了“错误”的力量。图片来源:magicalquote.com
在近期大热的电视剧《西部世界》中,西部世界创始人福特用这句话强调了“错误”的作用。演化的工具箱里显然不只有“错误”,但这些错误带来的能被后代继承的“变化”,的确是让生命之树的每个枝桠都灿烂多姿的重要原因——每一次DNA复制都会有极其微小的概率产生一点点错误,而这微小的差错又有微小的可能会让其后代产生些许不同,这种不同又有极其微小的概率让它们稍微能够更好地适应环境……亿万斯年,点点微小差错的积累,借着环境选择之手的引导,让自然界所有生物都处在永恒不断地变化发展之中。
在变化中奔向复杂
尽管演化理论如此优美,并不是所有人都认同生命的种种神奇都能够由无数细微的变化造就。在各种对演化思想的质疑中,有一种观点认为,人们所观察到的一些生物化学结构,需要由许多不同部件彼此协作才能保证其基本功能的行使。这些结构太过复杂,因此无法用演化机制来解释。美国生化学家迈克尔·贝希(Michael Behe)把这种情况称为“不可还原的复杂性”(Irreducible complexity),并主张这样的复杂性可能是“智能设计”的产物。
被当做具有“不可还原的复杂性”的典型结构是眼睛。我们的眼睛确实是极其复杂的器官,直觉上很难想象大自然会分别演化出晶状体、虹膜、视网膜等等单独拿出来没什么用的结构来配合成一个这么“有用”的眼睛。但这样的复杂性,真的“不可还原”吗?
在研究了大量化石和基因之后,瑞士发育学家沃尔特·雅各布·格林(Walter Jakob Gehring)发现尽管自然界不同物种的眼睛千变万化,但是总能通过积累各种细小的改变演化而来。
目前研究最透彻的一种眼睛演化路线是这样的[1]:原始生物中具有感光能力的蛋白质富集到某些细胞当中,让这些细胞成了最早的感光细胞。当感光细胞附近又加上一个能够阻挡光线的挡光细胞时,由于挡光细胞可以挡住某几个方向来的光线,感光细胞就可以大概知道光线照来的方向——这种只有两个细胞的结构。就是原始的眼睛(眼点)了,而现在所有动物的眼睛,都是由这种结构演变而来的。
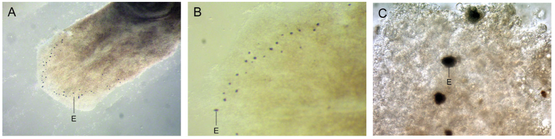 在某些现生涡虫(比如上图所示的Polycelis auricularia)当中还能看到这种最原始的眼点,其结构非常简单,一个眼点实际上只包含两个细胞,一个色素细胞(挡光),一个光受体细胞(感光)。图片来源:参考资料[1]
在某些现生涡虫(比如上图所示的Polycelis auricularia)当中还能看到这种最原始的眼点,其结构非常简单,一个眼点实际上只包含两个细胞,一个色素细胞(挡光),一个光受体细胞(感光)。图片来源:参考资料[1]
接下来,发生在感光细胞中的变化让这种眼的功能变得更细致:感光细胞聚集成感光层并向内凹陷,就能更加精确地知道光线射来的方向。这凹陷的极致,就是感光层内陷成一个腔体,周围完全被挡光层覆盖,只留下一个小孔与外界连通——这个小孔,便成了瞳孔的雏形。但是这样的空腔状眼睛非常脆弱还容易掉进脏东西,于是眼睛内就出现了一些细胞分泌的粘液作为填充物,再后来变成了某种透明的胶状物,而这些胶状物随着时间积累又分化出了晶状体和虹膜等结构。
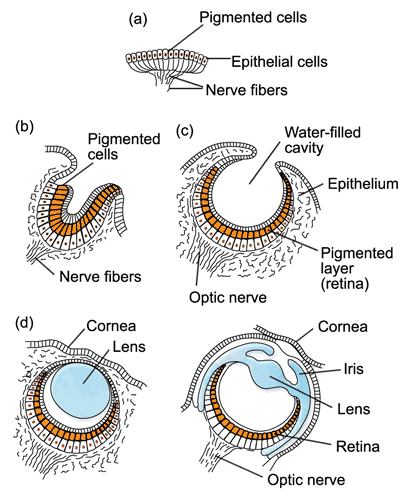 眼睛的一种演化路线(见于章鱼等头足类动物):a一层色素细胞,一层感光细胞;b眼点凹陷,强化对光线来源方向的感知;c 感光层内陷成腔体,外围完全被挡光层覆盖,只留下小孔与外界相通,能够“小孔成像”产生粗略视觉;d 眼睛外围覆盖上透明外皮层,保护眼睛不受侵害,之后透明外皮中不断分化产生晶状体、瞳孔等结构。人类的眼睛演化路线与此并不完全相同,但是最终都产生了相似的结构。图片来源:Remember the dot/Wikipedia
眼睛的一种演化路线(见于章鱼等头足类动物):a一层色素细胞,一层感光细胞;b眼点凹陷,强化对光线来源方向的感知;c 感光层内陷成腔体,外围完全被挡光层覆盖,只留下小孔与外界相通,能够“小孔成像”产生粗略视觉;d 眼睛外围覆盖上透明外皮层,保护眼睛不受侵害,之后透明外皮中不断分化产生晶状体、瞳孔等结构。人类的眼睛演化路线与此并不完全相同,但是最终都产生了相似的结构。图片来源:Remember the dot/Wikipedia
格林教授不但厘清了眼睛演化的历程,更是通过分子生物学技术将每一点演化所需的基因突变数量都给算了出来。事实上,有演化动力学研究表明,在环境选择压力比较强的情况下,从最原始的眼点演化成功能完善的眼睛,保守的估计也只需几十万年时间[2]。像我们双眼那样的复杂精致,的确可以被“还原”到非常简单。
蛋白质的华丽转身
有人或许还会追问,智慧生物可以在洞悉自然原理后设计出某种装置的核心部件(譬如机械钟表的发条),那么眼睛最核心的部件,感光细胞当中的感光蛋白最早是从哪里来的呢?
最有可能的答案是“借用”。简单来说就,是某种本来作其它用途的基因因为偶然的突变而转变功能(由于同一个基因在细胞基因组内可以有很多备份,因此这未必意味着原有功能的丧失)。作为光敏蛋白为我们所熟知的视紫质原本可能另有作用。
自然界最经典的“借用”案例大概得属细菌的鞭毛。它们可以像螺旋桨一样飞速旋转,从而让细菌能够四处游动。
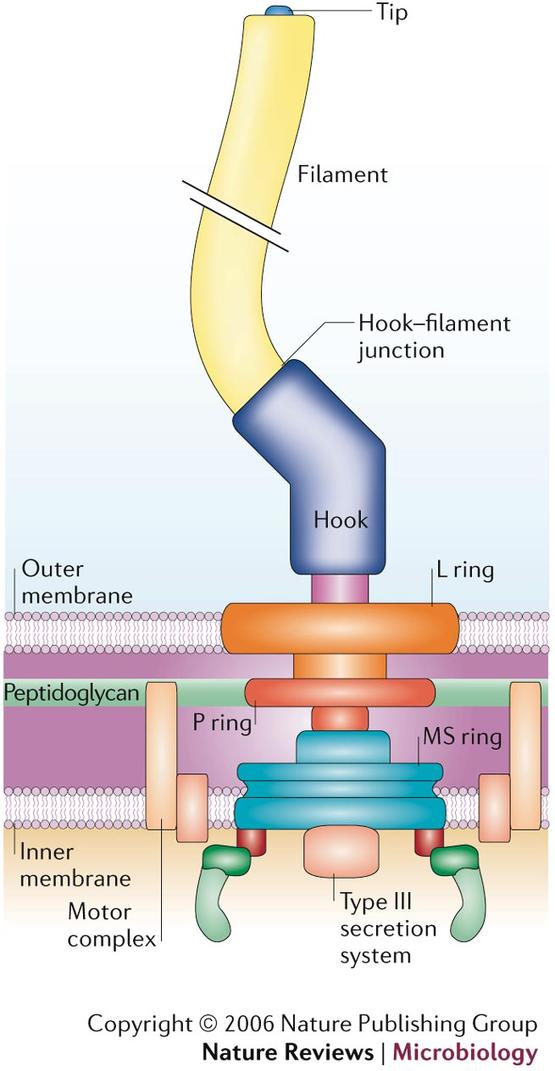 一个细菌鞭毛的模式图,其中包含一个精巧的动力旋转系统。图片来源:Nature Reviews Microbiology 4, 784-790 doi:10.1038/nrmicro1493
一个细菌鞭毛的模式图,其中包含一个精巧的动力旋转系统。图片来源:Nature Reviews Microbiology 4, 784-790 doi:10.1038/nrmicro1493
这厉害的功能,基本依赖于细菌鞭毛基部那个由数十种蛋白质构成的精巧的“分子电动机”。少了其中任何一种蛋白质组分,这个“分子电动机”都无法正常运转,而这些蛋白质离开了这个系统貌似也没了作用——因此,在生物学家揭开鞭毛的分子生物学本质之前,鞭毛也一度成为“不可还原复杂性”的另一个“例证”。但是科学家们很快发现,鞭毛中这个“分子电动机”其实是由一种“分子发电机”改造而来的,那便是每种需氧生物都必备的ATP合成酶。
 一个运作中的ATP合成酶示意图。图片来源:blogspot.com
一个运作中的ATP合成酶示意图。图片来源:blogspot.com
在细胞中,许多蛋白质都有这样一颗说跳槽就能跳槽的心,一点改变,多种可能。尽管鞭毛这一结构令人惊叹,但它的核心蛋白这种从“发电机”变成“电动机”的转身还算不上多华丽,毕竟这两者本来就差不多嘛。那么,蛋白质的潜能可以被发挥到什么地步?不久前,一项发表在《科学》杂志上的研究[3],让不少人又一次被生命的变化惊得瞠目结舌。
让生命将硅碳相连
在实验中,美国科学家弗朗西斯·阿诺德(Frances H. Arnold)等人盯上了来自海洋红嗜热盐菌(Rhodothermus marinus)的细胞色素c(Cytochrome c)。细胞色素c广泛分布于几乎所有需要氧气的生物体内(各种生物的细胞色素c略有差异),是细胞有氧呼吸过程中不可或缺的一种功能蛋白。它的本职工作是充当一个“电子搬运工”,帮助有机物氧化反应的有序进行。
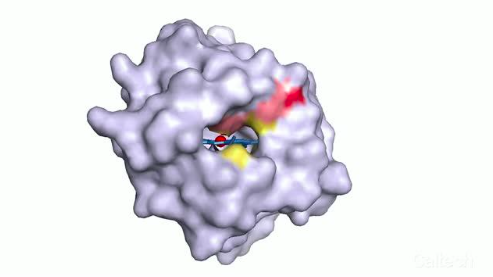 海洋红嗜热盐菌的细胞色素c结构。这个看上去平平无奇的蛋白质将在人工选择下表露令人震惊的功能。图片来源:FRANCES ARNOLD LAB/CALTECH
海洋红嗜热盐菌的细胞色素c结构。这个看上去平平无奇的蛋白质将在人工选择下表露令人震惊的功能。图片来源:FRANCES ARNOLD LAB/CALTECH
科学家认为,正是由于细胞色素c能参与到许多氧化反应当中去,所以这种蛋白质其实完全可以充当一种酶,去促进多种化学键的形成。他们通过酶动力学计算后发现,细胞色素c甚至有潜力催化形成一种在生物体内从未出现过的化学键——碳-硅键。
硅元素与构成生物体的主体元素碳性质相似,不过由于自然界的硅大多以硅酸盐的形式存在,生物体一般无法利用,所以硅对绝大多数生物而言是没什么用的(诸如硅藻等生物可以利用硅酸盐或二氧化硅构建自己的外骨骼,但它们只是整体性地利用环境中的硅酸盐,而不能把其中的硅元素分离出来利用)。
科学家根据酶动力学的测算,为这种细胞色素c“量身定制”了一类含有硅元素的有机小分子底物,果然发现很多物种的细胞色素c都能催化这些小分子形成碳-硅键,而海洋红嗜热盐菌的细胞色素c是其中的佼佼者。
不过这毕竟不是细胞色素c的本职工作,所以事实上它的工作完成得也不算太出色,除了催化产生科学家期望中的碳-硅键外,细胞色素c还容易将底物催化产生出各种乱七八糟的副产物。那么,需要多少基因突变才能将这么一种“业余酶”转职成“专业酶”呢?
三个点突变。
只需改变海洋红嗜热盐菌细胞色素c当中的三个氨基酸就足以完成这一转化,而且其中每一个点突变都能增强催化碳-硅键的专一性。经历这些变化之后,它们能在室温环境下催化产生碳-硅键。
 海洋红嗜热盐菌细胞色素c当中三个可以增强催化碳-硅键专一性的点突变,三个点都突变以后,这种“酶”的催化碳-硅键生成的专一性就达到了非常高的水平。图片来源:参考资料[3]
海洋红嗜热盐菌细胞色素c当中三个可以增强催化碳-硅键专一性的点突变,三个点都突变以后,这种“酶”的催化碳-硅键生成的专一性就达到了非常高的水平。图片来源:参考资料[3]
相比之下,人工合成碳-硅键的过程不但成本相对高昂,而且涉及有毒试剂,还会形成各式各样的副产物。借助自然的变化之力,人们在化工生产方面可能获得更惊人的发展——生命用了几十亿年的“实验”得到了数以万亿计的酶,而这其中的每一种,都或许可以通过简单的改造而变得更稳定,更高效乃至开发出全新的功能。
阿诺德的实验也引人遐思:这些研究结果或许意味着,如果某一天环境剧变,地球上突然多出了很多有机硅小分子,那么也许只需要几年时间,海洋红嗜热盐菌就能演化出利用硅的能力——而工具是一种功能原本与此八竿子打不着的蛋白质。“这研究展示了自然适应新挑战的速度之快。”阿诺德说。
 论文的第三作者陈凯(左)和第一作者Sek Bik Jennifer Kan博士(右)在实验室。图片来源:Caltech
论文的第三作者陈凯(左)和第一作者Sek Bik Jennifer Kan博士(右)在实验室。图片来源:Caltech
可见,从来就没什么“天不变,道亦不变”。这些DNA编码的催化机器能够在变化和选择之中不断为自己赋予新的价值——事实上它们也的确这么做了,从而让演化之树繁荣生长,最终铸就精彩纷呈的生物界。可以想象,也许最早的时候,最原始的生命体中总共也只有那么极少的若干种生命必不可少的基因,但经过这几种基因不断的自我复制与改变,经过无数时间,那点点滴滴的改变才终于衍生出世间的精彩纷呈。
或许真的只有变化,才是生命世界唯一不变的铁律吧。
(编辑:Calo)
参考资料:
- Gehring WJ. Chance and necessity in eye evolution. Genome Biol Evol. 2011;3:1053-66.
- Nilsson DE, Pelger S. A pessimistic estimate of the time required for an eye to evolve. Proc Biol Sci. 1994. 256(1345):53-8.
- Kan SB, Lewis RD, Chen K, Arnold FH. Directed evolution of cytochrome c for carbon-silicon bond formation: Bringing silicon to life. Science. 2016. 354(6315):1048-1051.
文章题图:陈磊、美丽科学
