那是大约50年前,一个普通的早晨,警察在洛杉矶市中心拦停了正在开车的莉奥诺‧韦克斯勒(Leonore Wexler)。警察怀疑莉奥诺喝了酒,因为她无法控制方向盘导致违反交通规则,但是酒精检测结果显示她没有饮酒。
这已经不是莉奥诺第一次出现类似状况了。刚开始大家以为她只是受到某种忧郁症的困扰,偶尔发生情绪波动和行为异常,但是病情多次发作之后,她的前夫,米尔顿‧韦克斯勒(Milton Wexler),一位著名的精神病学家,决定带她去医院检查。检查结果确诊莉奥诺患有亨廷顿病——一种已经夺去了她父亲和三个兄弟生命的致死遗传病。
从某种意义上讲,或许正是由于莉奥诺所遭遇的不幸,才开启了人类重新认识和征服这种病魔的新篇章。
 莉奥诺发病前与前夫米尔顿及两个女儿的家庭照(左:爱丽丝,右:南希)。图片来源:laskerfoundation
莉奥诺发病前与前夫米尔顿及两个女儿的家庭照(左:爱丽丝,右:南希)。图片来源:laskerfoundation
重新认识
其实这种病的症状从中世纪开始就有记载。到1872年,美国哥伦比亚大学研究生乔治‧亨廷顿(George Huntington)首次准确将其描述为一种典型的显性遗传病——如果父母有一人患,他们的子女有50%的概率患病,如果子女没有患病,则这些健康子女的后代也不会患病。从那之后,人们把这种病称为亨廷顿病。因为患者经常出现不由自主的手舞足蹈,这种病又被称为亨廷顿舞蹈症。
尽管父亲和三个兄弟相继因亨廷顿病死去,莉奥诺却误以为这种病“传男不传女”,不会出现自己身上,没曾想最终难逃宿命。被确诊后不久,莉奥诺开始时常表现出痉挛性抽搐和舞蹈样动作。随着病情持续恶化,她的动作完全无法自控,说话也含糊不清。再后来变得神情呆滞、日渐消瘦,最终不幸逝世。
与莉奥诺的发病过程相类似,大多数亨廷顿病患者都因为大脑神经功能失调,表现出渐进性的疾病进程。患者初次发病一般在30岁到50岁之间,只是一些轻微的动作失调,之后出现全身痉挛、严重认知障碍等症状,最终因营养不良、痴呆或感染等并发症死亡。
 亨廷顿病患者 | 图片来源:The Western Journal of Medicine
亨廷顿病患者 | 图片来源:The Western Journal of Medicine
流行病调查显示,亨廷顿病属于一种罕见遗传病。全世界亨廷顿病发病率约为每10万人2.7例。欧美国家的发病率相对较高,每10万人发病人数达5.7例;亚洲发病率相对较低,每10万人中仅有0.4例。
当时的人们既不清楚亨廷顿病的病因,也没有任何治疗的手段,只是猜测是由某种基因突变引发的。但是,到底是什么基因突变导致了这种可怕的遗传病呢?
围猎基因
莉奥诺和米尔顿有两个女儿,分别都有50%的概率程罹患亨廷顿病。想让她们逃脱命运的审判,唯一的可能就是尽早找出亨廷顿病的病因和治疗方法。
米尔顿尽到自己最大的努力,来帮助前妻和女儿。莉奥诺确诊的同年,米尔顿就成立了 “遗传病基金会”,用于资助科学家研究亨廷顿病和其它罕见遗传病。其中一个重要研究方向就是找到亨廷顿病的致病基因。
莉奥诺的女儿南希‧韦克斯勒博士,很早就从父亲那里得知自己可能患上和母亲一样的可怕疾病。但她渐渐克服了内心的恐惧,不甘于在亨廷顿病的威胁中虚度生命,决定亲自加入到亨廷顿病致病基因的研究团队中。
南希所在的时代还没有发达的测序技术,但她立志揭开亨廷顿病的谜底,哪怕是大海捞针,也要从复杂庞大的人类基因组中揪出导致亨廷顿病的元凶。
 正在展开遗传图谱的南希博士。图片来源:thespinoff
正在展开遗传图谱的南希博士。图片来源:thespinoff
当时获取致病基因最好的方法是遗传连锁分析。这一方法最关键是要有足够数量的多代遗传患者家族,以保障预测结果的准确性。而美国的亨廷顿病患者非常分散,找不到适合的研究群体。
幸运的是,南希在一次学术会议上偶然得知,在委内瑞拉马拉开波湖边的一个贫民窟生活着很多亨廷顿病疑似患者。南希敏锐地意识到这是一个不可错过的机会,于是决定前往委内瑞拉贫民窟,结果确诊其中很多人都患有亨廷顿病,而且有些家庭三代人同时患病。这些病例为亨廷顿病致病基因的查找提供了庞大的数据库。
于是,在之后的十年多年里,南希博士及同事数次往返美国和委内瑞拉,一边给这些患者提供最大的医疗援助,一边建立了包含18000多人的遗传谱系,采集了4000多个患者的血液样品,由6个不同实验室、 100多位科学家一起围捕亨廷顿病的致病基因。最终将亨廷顿病的致病基因精确定位在人类第4号染色体短臂上,分离出亨廷顿病基因序列,并推测亨廷顿基因中一个三联核苷酸(CAG)重复数不稳定是亨廷顿病重要的致病原因。这是科学家利用遗传连锁分析方法发现的第一个与人类遗传病相关的基因,这一研究成果发表在了国际顶级学术期刊《细胞》上。南希本人也因此得了1993 年的阿尔伯特·拉斯克公共服务奖和1994 年的J. 艾琳·泰勒国际医学奖。
病因初现
不过,发现亨廷顿基因并不意味着人类能马上打开亨廷顿病治疗的大门,这只是认识和战胜亨廷顿病漫漫征程的开始。
后续的遗传检测结果表明,正常人群亨廷顿基因的CAG重复少于26个,自己和后代都不会得病;当CAG重复数在27-35范围时,自己不得病,后代有较小的概率患病;重复数为36-39时,自身有较大概率表现出症状,发病概率与年龄成正比,且后代有50%概率患病;当重复数等于或大于40时,自身必定患病,后代也有50%的概率患病。
三联核苷酸CAG对应谷氨酸,正是亨廷顿基因含有过多的CAG重复,导致其编码的蛋白质含有过多的谷氨酸,被称为“突变亨廷顿蛋白”。这种突变蛋白会引起大脑纹状体和皮质区域的神经退行性病变,成为引发亨廷顿病的重要原因之一,但是具体机制仍不清晰。
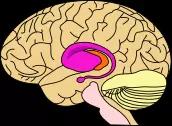 粉色为亨廷顿病早期对大脑的主要损伤部位。图片来源:Wikipedia
粉色为亨廷顿病早期对大脑的主要损伤部位。图片来源:Wikipedia
由于机制不明,迄今为止都还没有找到针对该病较为有效的药物和治疗方法。2008年8月15日,美国食品药品监督管理局批准了第一个治疗亨廷顿舞蹈症的药物——丁苯那嗪。但是该药物只能短时间部分缓解患者的舞蹈症状,其它治疗药物和手段疗效则更为有限。科学家们意识到,要战胜亨廷顿病并不能一蹴而就,除了通过胚胎基因筛查减少患儿出生之外,还必须深入研究突变亨廷顿蛋白如何引发神经性病变的。
动物帮忙
由于直接对人类亨廷顿病患者的神经系统进行研究很难实现,科学家只能寄希望于实验动物。
如果说亨廷顿基因的发现为人类打开了认识和攻克亨廷顿病的大门,那么精确模拟亨廷顿病症状及病理特征的动物模型则有望帮助人类找到彻底治愈亨廷顿病的药方。
早在1996年,科学家们就培育出携带人类亨廷顿基因的转基因小鼠,希望借此研究亨廷顿病的致病机理,找到治疗亨廷顿病的药物。世界各国科学家在之后20年建立了数百个亨廷顿病转基因小鼠模型,但是转基因小鼠无法呈现出亨廷顿病的大多数症状,特别是无法模仿患者的神经病理特征,因此在该病机理研究和药物筛选上成效甚微。
由于猴子等灵长类动物的神经系统与人类更为相近,科学家认为灵长类动物是研究人类神经系统疾病的理想模式动物。美国俄勒冈健康科学大学的Anthony·Chan团队,在2001年培育出世界第一只转基因猴之后不久,便开始了亨廷顿病转基因猴模型的研究。他们最终培育出能够用于长期观察亨廷顿病的转基因猴,并发现这些转基因猴脑部纹状体神经元减少,与人类亨廷顿病相吻合。
 亨廷顿病转基因猴。图片来源:nature
亨廷顿病转基因猴。图片来源:nature
但由于转基因猴培育不仅难度大、成本高,还存在伦理问题,科学家们不得不寻找其他替代动物,比如常见的家养动物——猪。
 健康猪与亨廷顿病转基因猪。图片来源:Cell
健康猪与亨廷顿病转基因猪。图片来源:Cell
猪的饲养成本较低,基因操作和克隆技术也相对较为成熟。这些转基因猪模型不但能表现出类似亨廷顿病的“舞蹈样”行为异常和过早死亡,而且能模拟亨廷顿病患者在大脑纹状体典型病理特征。更重要的是,这些异常行为及病理特征都可稳定地遗传给后代。
亨廷顿病猪模型的成功建立,对于科学家们长期深入了解亨廷顿病患者神经细胞的死亡机制有着重要意义。我们期待这些“转基因二师兄”们,能尽早为攻克亨廷顿病立下战功。(编辑:明天)
参考文献:
- Peter Forbes. How close are we to a cure for Huntington's? https://www.independent.co.uk/news/long_reads/how-close-are-we-to-a-cure-for-huntington-s-a8235921.html
- Elaine Woo. Milton Wexler: 1908-2007. A visionary who led a genetic revolution. March 22, 2007. http://articles.latimes.com/2007/mar/22/local/me-wexler22.
- Huntington's disease. https://en.wikipedia.org/wiki/Huntington%27s_disease
- Pringsheim T, Wiltshire K, Day L, Dykeman J, Steeves T, Jette N. The incidence and prevalence of Huntington's disease: a systematic review and meta-analysis. Mov Disord. 2012 Aug;27(9):1083-91. doi: 10.1002/mds.25075.
- Macdonald M (1993). "A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. The Huntington's Disease Collaborative Research Group". Cell. 72 (6): 971–83. doi:10.1016/0092-8674(93)90585-E. PMID 8458085.
- de Die-Smulders CE, de Wert GM, Liebaers I, Tibben A, Evers-Kiebooms G (2013). "Reproductive options for prospective parents in families with Huntington's disease: Clinical, psychological and ethical reflections". Human Reproduction Update. 19 (3): 304–315. doi:10.1093/humupd/dms058.
- Yang SH et al., Towards a transgenic model of Huntington's disease in a non-human primate. Nature. 2008 Jun 12;453(7197):921-4. doi: 10.1038/nature06975. Epub 2008 May 18.
- Meng Y, Jiang J, Bachevalier J, Zhang X, Chan AW. Developmental Whole Brain White Matter Alterations in Transgenic Huntington's Disease Monkey. Sci Rep. 2017 Mar 23;7(1):379. doi: 10.1038/s41598-017-00381-8.
